Covid: Anvisa precisa aprovar ‘rápido’ vacina de 2ª geração, pedem médicos
O aumento de casos de covid-19 no Brasil nas últimas semanas vem mobilizando associações médicas, que fazem um apelo para que a Anvisa (Agencia Nacional de Vigilância Sanitária) aprove “rapidamente” as vacinas de segunda geração da covid-19, mais eficazes porque foram desenvolvidas para atacar não apenas a cepa original do coronavírus, mas também a variante ômicron, dominante no Brasil e em outros países do mundo.
Como é a vacina de 2ª geração?
As farmacêuticas Moderna e Pfizer desenvolveram as chamadas vacinas bivalentes. Ao contrário dos imunizantes utilizados no Brasil, criados a partir da cepa original, a nova opção ataca também a variante ômicron, a principal responsável pelas infecções atualmente.
As duas vacinas utilizam RNA mensageiro: em vez de usar o vírus atenuado ou inativo, essa tecnologia induz o organismo a sintetizar uma proteína que impele o sistema imunológico a combater o coronavírus. Além disso, essas vacinas podem ser atualizadas mais rapidamente, permitindo adaptá-la às novas subvariantes da ômicron, com a BQ.1, que desembarcou no Brasil recentemente, é mais transmissível e já matou uma mulher idosa em São Paulo.
Aprovação da Anvisa se arrasta. A Moderna abriu negociações com a Anvisa para aprovação de seu imunizante ainda em março, há oito meses, enquanto a Pfizer fez o mesmo em agosto. Procurada, a Anvisa informou que “estão em fase final as análises das novas versões de vacina da Pfizer” para posterior envio à Diretoria da Agência “para deliberação”. “Não há ainda data fixada de decisão, mas a mesma deve ocorrer em breve”, diz.
Sobre o imunizante da Moderna, confirma que “a Anvisa realizou reuniões com a farmacêutica Moderna com o objetivo de explicar o funcionamento do processo de autorização de vacinas no Brasil”, mas a farmacêutica ainda “não ingressou com pedido de registro ou de autorização emergencial de vacina”.
“É importante esclarecer que nenhum processo de análise fica paralisado na Anvisa e que as análises de produtos, medicamentos e vacinas contra a covid-19 continuam sendo priorizadas”, diz a agência.
Foto: Getty Image
Já o Ministério da Saúde afirmou ao UOL que a “as vacinas fornecidas pelo Ministério da Saúde são as últimas versões aprovadas pela Anvisa” e que “o atual contrato com os fornecedores contempla a entrega de vacinas com cepas atualizadas, desde que aprovadas pela Anvisa”.
Diante da demora, a SBI (Sociedade Brasileira de Infectologia) pediu em comunicado desta semana para a Anvisa acelerar a avaliação e aprovação da vacina atualizada. Agora, a AMB (Associação Médica Brasileira) reforçou o pedido em seu mais recente boletim:
“[É preciso] promover rapidamente a aprovação e acesso às vacinas covid-19 bivalentes de segunda geração, que estão atualmente em análise pela Anvisa”.
Vacinas já são aplicadas no exterior
A vacina bivalente já é aplicada nos Estados Unidos, no Canadá e na Europa. No mês passado, o Chile passou a utilizar o novo imunizante para reforço em pessoas imunossuprimidas e profissionais de saúde.
O primeiro país a adotar a vacina da Moderna foi o Reino Unido, ainda em agosto. Nos Estados Unidos, a inclusão da nova geração da vacina ao sistema de saúde foi anunciada em setembro após aprovação da FDA (agência americana reguladora de medicamentos): o imunizante da Moderna agora é aplicado em pessoas com mais de 18 anos, enquanto o da Pfizer pode ser ministrado em indivíduos acima de 12 anos.
Remédios contra a covid já existem
Depois de muito tempo sem remédios indicados contra o coronavírus, alguns medicamentos já foram criados e aprovados pela Anvisa, como o antiviral molnupiravir, destinado a pacientes com quadros leves e moderados da doença. Outros seis remédios já haviam sido validados pela agência no final do ano passado.
O problema é que as drogas não chegam ao sistema público de saúde. “
É essencial que medicações já aprovadas pela Anvisa para o tratamento e prevenção da covid-19 estejam disponíveis para uso no setor público e privado, medida que ainda não se concretizou após mais de seis meses da licença para esses fármacos no Brasil”, afirma a AMB.
As máscaras vão voltar?
As associações também pedem ao governo que oriente a população a retomar algumas medidas de prevenção, “como uso de máscaras e distanciamento social, evitando situações de aglomeração principalmente pela população vulnerável, como idosos e imunossuprimidos”, defende a AMB.
Crianças são as principais vítimas
A SBI, AMB e a FNP (Frente Nacional de Prefeitos) também pedem atenção especial do governo à vacinação infantil contra a covid. Só uma em cada 10 crianças de 3 e 4 anos recebeu a primeira dose no Brasil, segundo reportagem da Folha de S.Paulo.
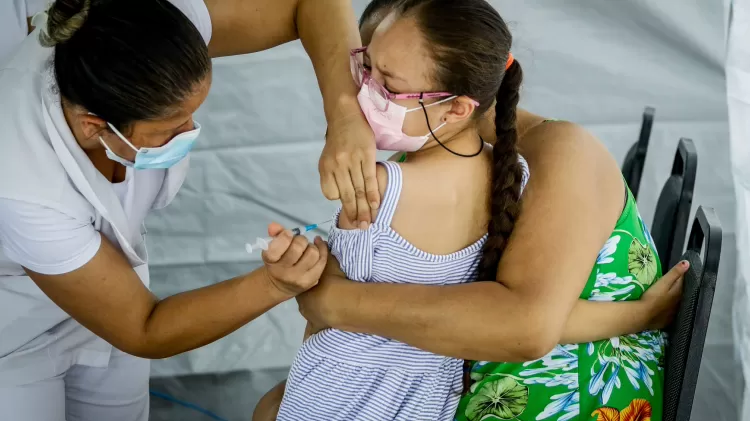
Foto: Aloísio Mauricio
Isso indica que apenas 14% das crianças dessa faixa etária iniciaram a trajetória vacinal. Já a vacinação com duas doses só alcançou 4,2% das crianças dessa faixa-etária.
A SBI pede para o governo federal “garantir aquisição de doses suficientes de vacina para imunizar todas as crianças de seis meses a 5 anos independente da presença de comorbidades”.
Já a FNP reclama da “irregularidade no envio aos municípios de imunizantes da Pfizer, indicados para aplicação em crianças com mais de seis meses e menores de três anos”.
“Além disso, é fundamental a retirada da orientação do Ministério da Saúde para que se apliquem as vacinas apenas em crianças com comorbidades (…) não há critérios seguros que permitam elencar comorbidades nessa faixa etária.”.
Questionado a respeito, o Ministério da Saúde afirmou em nota que iniciou na quinta-feira (10) a distribuição “de forma proporcional e igualitária” de 1 milhão de doses pediátricas contra a covid-19 “destinadas a crianças de seis meses a menores de três anos com comorbidades”.
“Com o fim da Emergência em Saúde Pública de Importância Nacional (ESPIN), a possibilidade da ampliação das doses para as crianças nessa faixa etária sem comorbidades será avaliada pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec).”.
- Suplente de vereador é morto a tiros de fuzil em Crato, na região do cariri, no interior do Ceará - 07/05/2024
- Jogos de Fortaleza e Ferroviário são adiados pela CBF por conta de tragédia no Rio Grande do Sul - 07/05/2024
- Três acusados de participação em chacina no Mondubim, em Fortaleza vão a júri popular - 07/05/2024